Persistencia del conducto arterioso.
Los términos ductus arterioso permeable (en inglés, patent) y ductus
arterioso persistente (en inglés, persistent) se han utilizado indistintamente en la
literatura científica, para indicar que el conducto arterioso está abierto y tiene flujo
a su través. Elegimos el término ductus arterioso persistente (PDA) porque hace
referencia a su presencia más allá del periodo neonatal en niños nacidos a
término. El término ductus arterioso permeable quedaría restringido al periodo
perinatal, especialmente a los niños prematuros.
Conociéndose por persistencia del conducto arterioso (PCA) a la cardiopatía
que presenta cuando no se produce el cierre espontáneo fisiológico y anatómico
del conducto arterioso en el tiempo establecido.
Para una mejor comprensión de esta cardiopatía, es necesario conocer la
circulación fetal.
I. CIRCULACIÓN FETAL (Figura Nº1)
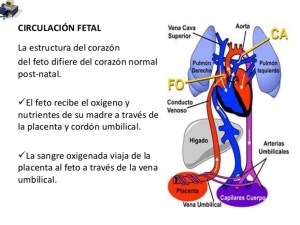 Las características más importantes son la presencia de:
Las características más importantes son la presencia de:
1. CORTOCIRCUITOS FETALES
Son tres:
a) El conducto arterioso que comunica la arteria pulmonar con la arteria aorta.
b) El foramen oval que comunica la aurícula derecha con la aurícula izquierda.
c) El conducto venoso que comunica la vena umbilical con la vena cava inferior.
2. FLUJOS PREFERENCIALES
Son dos:
a) La sangre de la vena cava inferior que transporta O2 a elevada
concentración (saturación 75%) proveniente de la placenta se dirige
preferencialmente hacia la aurícula izquierda a través del foramen oval. Esto
garantiza la oxigenación adecuada del cerebro y del miocardio fetal.
Comprenderemos ahora, por qué el cierre prenatal del foramen oval es causa de
muerte fetal.
b) La sangre de la vena cava superior que llega a la aurícula derecha se
dirige al ventrículo derecho -arteria pulmonar – conducto arterioso – aorta
descendente en un 60% del gasto cardiaco. Esto es debido a la resistencia
pulmonar elevada que no permite flujo sanguíneo a los pulmones.
La permeabilidad del conducto arterioso en el feto depende del estado de
hipoxemia de la circulación fetal y de la presencia de prostaglandinas E1 y E2
(producida por la placenta, el pulmón y la propia pared arterial del conducto);
ambas relajan y dilatan sus fibras musculares.
3. EL CIRCUITO UMBÍLICO-PLACENTARIO
La placenta maneja el 55% del gasto cardiaco y las funciones vitales que
desempeña son:
a) Intercambio de O2 y CO2 con sangre materna.
b) Entrada de anabólicos (glucosa, Ácidos grasos, agua).
c) Salida de catabolitos (urea, ácido láctico).
d) Función endocrina.
e) Producción de prostaglandina.
La causa de insuficiencia cardíaca en las primeras horas de nacimiento
puede ser la sobrecarga de volumen producida por la transfusión feto placentaria
si es que el recién nacido es colocado en una posición por debajo de la placenta.
Los términos ductus arterioso permeable (en inglés, patent) y ductus
arterioso persistente (en inglés, persistent) se han utilizado indistintamente en la
literatura científica, para indicar que el conducto arterioso está abierto y tiene flujo
a su través. Elegimos el término ductus arterioso persistente (PDA) porque hace
referencia a su presencia más allá del periodo neonatal en niños nacidos a
término. El término ductus arterioso permeable quedaría restringido al periodo
perinatal, especialmente a los niños prematuros.
Conociéndose por persistencia del conducto arterioso (PCA) a la cardiopatía
que presenta cuando no se produce el cierre espontáneo fisiológico y anatómico
del conducto arterioso en el tiempo establecido.
Para entender esta cardiopatía es necesario recordar la circulación
Fetal.
II. CIRCULACIÓN NEONATAL (Figura Nº2)
 Persistencia conducto arterioso
Persistencia conducto arterioso
Durante el nacimiento y en las primeras horas ocurren cambios importantes
que pasamos a detallar:
1. CIERRE DE LA CIRCULACIÓN UMBÍLICO PLACENTARIA
Se produce con la, ligadura del cordón umbilical en el recién nacido,
excluyendo la placenta de la circulación. La placenta es un órgano sumamente
vascularizado, y por lo tanto de resistencia vascular disminuida para acomodar un
gran volumen de sangre; su exclusión provoca un aumento de la resistencia
vascular sistémica con aumento de la presión aórtica a mayores niveles que la
presión de la arteria pulmonar.
Igualmente, al ligar el cordón cesa el flujo de la sangre por el conducto
venoso, disminuyendo el retorno venoso por la vena cava inferior al corazón del
recién nacido.
2. CIERRE E INVERSIÓN DE LOS FLUJOS SANGUÍNEOS POR LOS
CIRCUÍTOS FETALES
a) Cierre del foramen oval
– Cierre funcional: se produce en las primeras horas de vida por disminución
del retorno venoso y consecuente disminución de la presión en la aurícula
derecha. Igualmente hay un aumento del flujo pulmonar con aumento de la presión
de la aurícula izquierda. Así la mayor presión de la aurícula Izquierda respecto a la
aurícula derecha, aunada a la presión intratorácica negativa, cierra funcionalmente
el foramen oval; incluso en las primeras horas puede haber cortocircuito de
izquierda a derecha por mayor presión en la aurícula izquierda.
– Cierre anatómico: el foramen oval persiste anatómicamente abierto hasta
los 5 años en el 50% de la población y hasta los 20 años en el 25%.
b) Cierre del conducto arterioso
– Cierre funcional: se realiza en las 24 horas de vida y es debido, a la acción
del oxígeno que al aumentar su concentración en el nacimiento produce
vasoconstricción ductal. También hay efecto de la menor producción de
prostaglandina E1 y E2 porque desaparece la producción placentaria, induciendo
conjuntamente con el oxígeno vasoconstricción en el conducto arterioso.
Por ello la administración de inhibidores de prostaglandina (Indometacina, Ácido
salicílico) a las madres gestantes es peligrosa por la posibilidad de cierre prenatal
del conducto arterioso. Por otro lado se puede usar estos inhibidores de
prostaglandina para cerrar el conducto arterioso en neonatos prematuros con
persistencia del conducto arterioso y cortocircuito de izquierda a derecha que
produzca insuficiencia cardíaca.
En un grupo de neonatos con cardiopatía congénita y flujo pulmonar dependiente
del conducto arterioso es vital mantener abierto el conducto; de ahí que el uso de
prostaglandinas para este grupo de pacientes está indicado.
– Cierre anatómico: se realiza en un 90% de casos a los 60 días de vida.
3. AUMENTO DE LA CIRCULACIÓN PULMONAR
En la vida fetal, la circulación pulmonar está marcadamente disminuida (7%
del gasto cardiaco) debido, a la hipoxemia fetal y a que los alvéolos están
colapsados, ambos producen un aumento en la resistencia pulmonar.
En el momento del nacimiento ocurre un cambio brusco en la circulación
pulmonar: disminuye marcadamente la resistencia, la presión de la arteria
pulmonar a las 24 horas de vida es 50% menor que la presión aórtica y el flujo
pulmonar aumenta de 4 a 10 veces más que en el feto. Estos cambios son
consecuencia de la expansión de los alvéolos por la respiración que aumenta la
PaO2 y la saturación de hemoglobina a 96%. El O2 tiene acción vasodilatadora
sobre las arteriolas pulmonares.
La resistencia pulmonar tiene disminución progresiva posterior al nacimiento
y al final del primer año alcanza los valores del adulto.
En cambio el flujo pulmonar, después del primer mes de vida, tiene un
aumento progresivo.
Aquí encontramos la explicación fisiopatológica de como las cardiopatías con
cortocircuito de izquierda a derecha recién se manifiestan después del primer mes
de vida con insuficiencia cardíaca. También se explica las limitaciones que tiene el
examen clínico para el diagnóstico en esta etapa de la vida: los soplos sistólicos,
diastólicos y el carácter del segundo ruido -que característicamente se auscultan
después del primer mes de vida- no son audibles antes de esta etapa por las
presiones y resistencias elevadas en el circuito pulmonar. Esto hace difícil el
diagnóstico clínico, en etapa neonatal y es donde la utilidad de la ecocardiografía
se hace más evidente.
Los pulmones del feto en ausencia de su función de intercambio
gaseoso, solo reciben una pequeña porción del volumen de sangre el 4-15%
de lo que expulsa hacia la arteria pulmonar.
En su mayor parte la sangre de arteria pulmonar, se deriva hacia la
aorta torácica a través del conducto arterioso, que transporta un 60% del
volumen sanguíneo total hacia la Aorta torácica y abdominal.
El Ductus es más frecuente en el prematuro, generalmente producto de su
inmadurez, siendo a su vez más frecuente en estos pacientes su cierre
espontáneo a medida que va madurando el niño.
En el niño a término es menos frecuente la presencia del Ductus, pero sí es
más difícil de cerrar espontáneamente en el caso de presentarse, ya que
generalmente la PCA se debe a una malformación congénita relacionada muy
probablemente con un defecto anatómico primario del tejido elástico de la pared
del conducto arterioso.
Desde el punto de vista hemodinámico la persistencia del conducto arterioso
se caracteriza por un corto circuito de aorta a pulmonar produciéndose un
hiperflujo sanguíneo pulmonar, el cual es llevado a través de las venas
pulmonares a aurículas y ventrículos izquierdos que se dilatarán producto de la
sobrecarga de volumen que reciben.
CLINICAMENTE SE CARACTERIZA.
. Cansancio fácil y sudoración en la alimentación.
. Pobre ganancia de peso.
. Polipnea y tiraje.
. Infecciones respiratorias bajas a repetición.
. Insuficiencia Cardiaca.
Cuando la PCA es pequeña, no se aprecian manifestaciones clínicas
evidentes y se sospecha la cardiopatía por la detección fortuita de un soplo
sistólico de poca intensidad (I-II/VI) en región infraclavicular izquierda.
Al examen físico del aparato cardiovascular.
Inspección
Se presenta un precordio que puede estar normal o abombado e
hiperdinámico. Latido de la punta visible desplazado por fuera y hacia abajo del
5to espacio intercostal línea medio clavicular.
Palpación.
Normal si es una PCA pequeña. En las moderada o grande, el latido de la
punta palpable desplazado por fuera y hacia abajo del 5to espacio intercostal línea
medio clavicular. Frémito sistólico o sistodiastólico en región infraclavicular
izquierda. Los pulsos femorales saltones y pueden detectarse una tensión arterial
diferencial amplia
Auscultación.
Ruidos cardiacos rítmicos.1er ruido normal. Soplo sistólico de intensidad
variable localizado en región infra clavicular izquierda. 2do ruido normal y
presencia de retumbo mitral si la cardiopatía tiene repercusión hemodinámica. 3er
ruido y taquicardia, si insuficiencia cardíaca.
Es de señalar que el soplo de esta cardiopatía sufre una secuencia
auscultatoria. En la etapa de Recién Nacido, es un soplo sistólico en RICI.
Lactante pequeño es sistodiastólico y en el lactante mayor es continuo o en
maquinaria, pero siempre se localiza en RICI.
Los complementarios:
EKG
R altas en V5 y V6 (crecimiento ventricular izquierdo) y S profundas en V1
mayores del 98 percentil.
Q profundas en V5 y V6 (sobrecarga de volumen de cavidades izquierdas)
RX Tórax (Tele) Cardiomegalia a predominio de cavidades izquierdas y
prominencia del arco medio de la pulmonar. Flujo pulmonar aumentado.
ECOCARDIOGRAMA:
Presencia de la persistencia del conducto arterioso y su tamaño, dilatación
del tronco de la arteria pulmonar y dilatación de cavidades izquierdas.
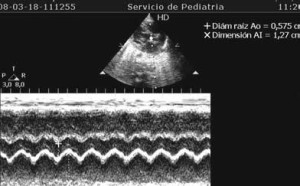
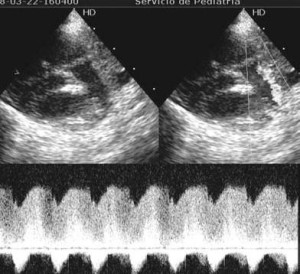
Figura 2. Eje paraesternal corto. Visión del ductus
Medición de la relación AI/Ao desde
Paraesternal eje largo
Figura 1. Eje paraesternal corto. Visión del ductus y el flujo de doppler contínuo
Hallazgos ecocardiográficos
Diámetro del DAP por doppler color
AI/ Ao
Fracción de acortamiento
Pequeño
<1.5 mm
<1.4
>40%
Moderado
1,5-2mm
1.4-1.6
30-40%
Grande
>2mm
>1.6
<30%
EVOLUCION NATURAL:
1- Cierre espontáneo (1 año)
2- Infecciones respiratorias frecuentes.
3- Insuficiencia cardiaca
4- Hipertensión pulmonar
5- Endarteritis infecciosa del ductus
6- Dilatación aneurismática con calcificación y rotura del ductus.
TRATAMIENTO.
1-Médico.
2-Quirúrgico.
Cuando la cardiopatía tiene repercusión hemodinámica.
. Digoxina (50mcg/20 gotas, Tabletas de 0.25mg=250mcg )
Dosis de 10 a 20 mcg/kg/día. Vía oral
Diuréticos.
. Espironolactona (tab 25 mg.)
. Furosemida (tab 40 mg).
Dosis para la vía oral de todos los diuréticos 1 -5mg/kg/día.
El tratamiento quirúrgico siempre antes de los 18 meses, por el riesgo de la
Hipertensión Pulmonar.
Dra. Teresita Vega Rivero
Especialista II Grado Pediatría.
Máster en Atención Integral al niño.
Cardiopediatra. Profesora Auxiliar.
BIBLIOGRAFÍA CONSULTADA
1. Tejera Ramírez C, Suárez Cabrera P, Antúnez Jiménez M, Falcón González H.
Ductus arterioso Persistente en el prematuro. Protocolos Diagnósticos y
terapéuticos en Cardiología Pediátrica. Cap33
2. Héctor Romero, Jana Pamela Peña. Manejo del paciente pretérmino con ductus
arterioso persistente. Repert.med.cir.2014; 23(3): 168-176
3. Cesar Saunas M. La circulación fetal y neonatal. Revista Peruana de Cardiología.
Julio – Setiembre 1993.
4. Espino Vela J. Cardiología Pediátrica, 2ª. ed. México, Ed. Méndez Oteo;1991.
p.31.
5. González Cerna JL. Evolución de la cirugía cardiovascular en el Hospital Infantil
de México. Conferencia magisterial “Federico Gómez”. XXVI Jornadas anuales.
Asociación de Médicos del Hospital Infantil de México “Federico Gómez”, 1996.
6. Mullins CE, Pagotto L. Patent ductus arteriosus en Garson Jr. A y Cols. The
Science and Practice of Pediatric Cardiology 2 a ed Baltimore Williams and
Wilkins Ed. 1998 pag. 1181-1199.
7. Vizcaíno-Alarcón A. ¿Cuál es la mejor forma de ocluir el conducto
arterioso? Bol. Med. Hosp. Inf. Mex. 2001;58: 297-302.
8. Arévalo-Salas A., Vizcaíno-Alarcón A., Hornedo-Andrade A., Erdmenger-
Orellana J., Reyes-de la Cruz L, Espinosa Islas G. Oclusión no quirúrgica
del conducto arterioso por cateterismo percutáneo. Bol. Med. Hosp. Infant Mex
2001:58:303-311.
9. Van Overmeire B, Smets K, Lecoutre D.A. Comparison of ibuprofen and
indomethacin for closure of patent ductus arteriosus. N Engl J Med
2000;343:674-8
10. Taylor RL, Glover FL, Harman PK. Operative closure of patent ductus
arteriosus in premature infants in the neonat al intensive care unit. Am J Surg
1986;22:1171-4.
